a écrit :
[center]Télé-réalité dans les cellules[/center]
Des chercheurs français ont pour la première fois réussi à visualiser dans la cellule les déplacements d'une protéine, la kinésine, chargée du transport des molécules d'un bout à l'autre de la cellule.
Un pas de plus a été franchi en matière de transport cellulaire : pour la première fois, des chercheurs français ont réussi à filmer la vie intime d'une molécule unique à l'intérieur d'une cellule. Giovanni Cappello et Yohanns Bellaïche, de l'Institut Curie, Maxime Dahan, du Laboratoire Kastler-Brossel (LKB)1, à Paris, et leurs équipes y ont suivi les déplacements de protéines, les kinésines. Ces dernières sont responsables du transport du matériel cellulaire. Elles se déplacent le long de filaments qui constituent le squelette de la cellule, les microtubules.
Les chercheurs ont tout d'abord isolé les kinésines et les ont marquées à l'aide de boîtes quantiques fluorescentes, ou « quantum dots » afin de pouvoir les visualiser. Ces sondes optiques sphériques, des nanoparticules composées de cristaux semi-conducteurs, sont particulièrement puissantes et permettent de suivre les mouvements des protéines pendant plusieurs jours. Ils ont ensuite injecté le couple kinésine-quantum dot dans une cellule de mammifère et ont suivi sous microscope l'activité des protéines. Ou plutôt de la protéine, car cette technique est effectivement la seule permettant actuellement de visualiser une molécule unique à l'intérieur de la cellule.
Selon les résultats, les kinésines alternent entre un mouvement linéaire, quand elles sont attachées aux microtubules, et des déplacements aléatoires, lorsqu'elles quittent ces microtubules. Elles sont capables d'assurer individuellement le transport d'une molécule (ou d'une organelle2 de petite taille) d'un bout à l'autre de la cellule grâce à une succession de phases d'accrochage et de décrochage. Et surtout, ces moteurs moléculaires conservent les mêmes caractéristiques dans la cellule et in vitro.
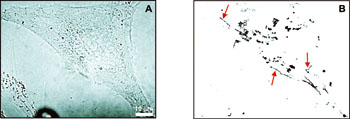
Dans une cellule en culture (à gauche), les chercheurs ont visualisé, en superposant 600 images (à droite), les trajectoires individuelles (indiquées par les flèches) de kinésines.
© M. Dahan, S. Courty et C. Luccardini, Y. Bellaiche et G. Cappello
Les mesures sont en effet conformes à celles réalisées in vitro depuis une dizaine d'années. « Ces résultats ouvrent toute une panoplie de possibilités pour d'autres types d'études dans la cellule », confie Giovanni Cappello. Appréhender par exemple des phénomènes cellulaires complexes encore méconnus, comme celui de la division cellulaire. « Les biologistes cherchent à comprendre comment la cellule parvient à déterminer son centre de symétrie et à donner naissance à deux cellules filles. C'est-à-dire comment sont exercées les forces qui permettent de tirer les chromosomes de part et d'autre de ce centre, comment sont positionnés les moteurs cellulaires et quelle est leur trajectoire. » Grâce à cette technique, les biologistes pourraient étudier de manière extrêmement fine les déplacements d'un moteur moléculaire unique le long d'un microtubule et en déduire un modèle de division cellulaire global simple. Autre application : en médecine. Les moteurs moléculaires peuvent également être utilisés comme nanotransporteurs pour délivrer un médicament.
Seule ombre au tableau : la technique nécessite encore quelques réglages. Pour le moment, les chercheurs ont utilisé des protéines isolées, purifiées mais… tronquées. La kinésine native est constituée du domaine moteur à une extrémité et du site d'accrochage à une autre. Les chercheurs ont coupé et remplacé ce site pour accrocher ici spécifiquement le quantum dot. Ils renouvellent actuellement l'expérience avec des protéines extraites directement de l'animal, des protéines de myosine 5 issues de cerveau de poulet qui ont été marquées à un endroit que l'on sait non fonctionnel. Ils entendent suivre cette fois le comportement d'une protéine complète dans son environnement d'origine. À suivre…
Séverine Duparcq
1. Laboratoire CNRS / Université Paris-VI / ENS Paris / Collège de France.
2. Petite structure interne différenciée (délimitée par une membrane) de la cellule vivante exerçant une fonction spécialisée dans la cellule.
téléréalité dans les cellules
1 message
• Page 1 sur 1
dans le journal du CNRS:
- canardos
- Message(s) : 18
- Inscription : 23 Déc 2005, 16:16
1 message
• Page 1 sur 1
Qui est en ligne ?
Utilisateur(s) parcourant ce forum : Aucun utilisateur inscrit et 19 invité(s)