a écrit :
[center]Vie et mort des cellules : l'enquête progresse[/center]
Des anomalies dans la mort programmée des cellules, ou apoptose, sont fortement impliquées dans les cancers. Deux travaux menés par des chercheurs du CNRS viennent aujourd'hui préciser certains mécanismes moléculaires mis en jeu.
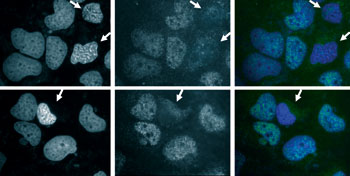
Lors de la mort des cellules par apoptose (superposition à droite), les protéines HDAC3 (au centre) sont exclues du noyau (à gauche).
© F. Escaffit
Véritable casse-tête que cette résistance des cellules cancéreuses à la mort… Car contrairement aux cellules normales, elles sont insensibles aux signaux censés déclencher leur suicide, et donc prolifèrent. Mieux connaître les processus de vie et de mort des cellules est donc la clef des futurs traitements. Deux séries de travaux viennent de marquer des avancées importantes dans ce domaine.
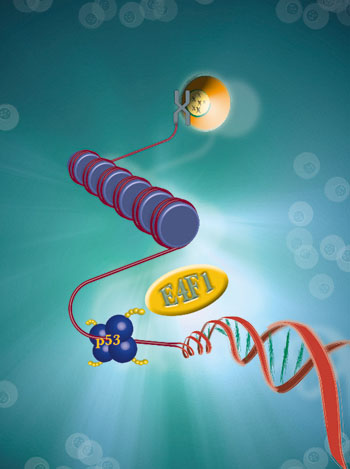
La première d'entre elles est l'œuvre de chercheurs de l'Institut de génétique moléculaire de Montpellier (IGMM)1 et du Centre de recherche en biochimie macromoléculaire (CRBM)2. Ils viennent de prouver3 que certains processus de cancérisation dépendent de la surexpression ou de l'inactivation de la protéine E4F1, présente dans toutes les cellules et impliquée dans l'expression des gènes. Les expériences le montrent : « Lorsque E4F1 est inhibée dans la peau de souris, les cellules de l'épiderme entrent massivement en division : en moins de dix jours, un épaississement spectaculaire de cet épiderme apparaît (il passe de trois couches à plus d'une trentaine), à la manière de ce qui est observé au cours des premières étapes de nombreux cancers de la peau. À l'inverse, la surexpression de cette protéine dans des cellules isolées bloque leur division et les protège de la mort », explique ainsi Laurent Le Cam, chercheur à l'IGMM. Une telle influence provient notamment de son interaction avec la protéine p53, qui est un rouage central dans l'orientation du devenir d'une cellule vers la prolifération ou au contraire vers l'apoptose, ou mort cellulaire programmée. En outre, E4F1 est associée à trois autres « suppresseurs » de tumeurs avérés et elle est la cible de plusieurs accélérateurs du développement des cancers. « En résumé, E4F1 agit au carrefour de plusieurs voies de régulation du processus de division et de mort cellulaire », insiste Claude Sardet, directeur de recherche à l'IGMM. Ce rôle central en fait une « molécule d'avenir » et une cible thérapeutique potentielle dans la lutte contre certains cancers.
Rôle régulateur d'E4F1, qui oriente la cellule vers la prolifération ou l'apoptose en greffant des chaînes de protéines sur p53 (vue d'artiste).
© L.Le Cam, C. Sardet, Cell, Nov 2006/P. Schuman et E. Picard, ISIS-IFR122
Pour la seconde série de découvertes, direction Toulouse, où une équipe de chercheurs du Laboratoire de biologie moléculaire des eucaryotes (LBME)4 a mis en évidence différents aspects du rôle de l'enzyme HDAC3 dans l'apoptose. En premier lieu : la mort programmée de la cellule est freinée tant que cette enzyme est présente dans le noyau5. En effet, elle empêche l'expression des gènes qui favorisent l'apoptose. Ils ont observé que « lorsque l'on déclenche l'apoptose des cellules par irradiation UV ou traitement chimique, cette protéine subit une rupture de sa partie “C-terminale”, qui lui assurait de rester dans le noyau », selon Didier Trouche, directeur de recherche au LBME. HDAC3 est alors évacuée vers le cytoplasme, et le suicide cellulaire peut avoir lieu efficacement. Les chercheurs ont émis l'hypothèse qu'en favorisant ce clivage dans les cellules cancéreuses, il serait alors possible de développer une arme redoutable pour les sensibiliser aux traitements anticancéreux. Première étape, nos chercheurs ont déjà « reproduit l'expérience sur de nombreux types de cellules cancéreuses chez l'homme aussi bien que chez le poulet », précise Fabrice Escaffit, postdoctorant au LBME.
Pour préciser l'influence de HDAC3 dans le noyau, ils ont utilisé des lignées de cellules produites par une équipe japonaise de l'université de Miyazaki. Résultat : elle interagit notamment avec le gène fas, gène-clé de la mort cellulaire. C'est donc via fas que HDAC3 est impliquée dans le déclenchement de l'apoptose et l'entretien du processus. Maintenant, l'équipe cherche à déterminer les autres cibles de cette enzyme, pour préciser l'action de futurs inhibiteurs thérapeutiques, car déjà certains sont en essais cliniques au Canada. L'intuition de Didier Trouche est prometteuse : « Elle pourrait aussi inhiber p53, protéine essentielle pour la surveillance de l'intégrité de l'ADN. » Une piste à suivre.
Aude Olivier
1. Institut CNRS / Universités Montpellier-I et II.
2. Centre CNRS / Universités Montpellier-I et II.
3. Cell, vol. 127, n° 4, 17 novembre 2006, pp. 775-788.
4. Laboratoire CNRS / Université Toulouse-III.
5. Molecular and Cellular Biology, vol. 27, n° 2, pp. 554-567, janvier 2007.
vie et mort des cellules
1 message
• Page 1 sur 1
dans le journal du CNRS de mai 2007:
- canardos
- Message(s) : 18
- Inscription : 23 Déc 2005, 16:16
1 message
• Page 1 sur 1
Qui est en ligne ?
Utilisateur(s) parcourant ce forum : Aucun utilisateur inscrit et 17 invité(s)